Come l'acqua calma nel placido stagno non svela quanto sia capace di precipitarsi con fragore da una roccia, così nessuno conosce quali forze porti dentro di sé per soffrire e agire.
Schopenhauer
Un superatomo è un insieme di atomi legati tra loro in un cluster che sembra esibire proprietà chimiche simili a quelle di atomi elementari. Le prime ricerche in questo campo furono compiute nel 2005 da studiosi della Virginia Commonwealth University.
Studi successivi hanno confermato che molti elementi della tavola periodica hanno un corrispettivo tra i superatomi. Ad esempio, 6 atomi di alluminio formano una molecola che ha caratteristiche simili al rutenio, 13 somigliano allo iodio (e, con l'aggiunta di un elettrone al sistema, si ottengono caratteristiche da gas nobile), 14 atomi di alluminio somigliano al calcio. La combinazione di una molecola di carbonio e una di tungsteno genera un superatomo che ha comportamento chimico simile al piombo. Allo stesso modo, nichel e tellurio, se combinati in diverse quantità, possono somigliare a singoli atomi di sodio, potassio e cloro.
La ricerca è impegnata a valutare la possibilità di sostituire, in applicazioni pratiche, degli atomi di materiali molto costosi o rari con dei superatomi di basso costo: ad esempio, sostituire il platino delle marmitte catalitiche con il carburo di tungsteno, suo equivalente; oppure, rimpiazzare il palladio usato in alcuni processi di combustione, con il monossido di zirconio.
Altro tema di interesse è la possibilità che dei superatomi, oltre a possedere proprietà chimiche analoghe, esibiscano proprietà ulteriori rispetto agli atomi a cui somigliano.
I superatomi, che possono essere formati solamente da specifici numeri di atomi, dipendenti dal particolare elemento considerato, si comportano come un singolo atomo perché il guscio elettronico esterno del cluster assume stranamente una conformazione simile allo strato esterno di un elemento della tavola periodica.
Secondo Schmidt-Ott i superatomi conferirebbero alla tavola periodica degli elementi una terza dimensione: "Le proprietà chimiche che abbiamo finora identificato sono molto simili a quelle degli elementi della tavola periodica, ma potremmo anche scoprire superatomi con uno strato esterno differente, che darebbe un altro insieme di proprietà completamente nuove."
Schmidt-Ott spera di trovare cluster di atomi dotati di proprietà magnetiche, ottiche ed elettriche inusuali, che potrebbero essere sufficientemente stabili da permettere la creazione di cristalli o oltre strutture solide, utilizzabili come catalizzatori per i processi di combustione e per ottenere cristalli
superconduttori.
Nel 2004, alcuni ricercatori capeggiati da S. N. Khanna, della Virginia Commonwealth University, dimostrarono l’evidenza delle caratteristiche da superalogeno del cluster molecolare di formula Al3I.
Facciamo un passo indietro, gli alogeni sono dei generatori di sali, come suggerisce il nome proveniente dal greco, e si trovano sulla tavola periodica lungo una fila verticale, subito a destra dei gas nobili ( Gli alogeni reagiscono con quasi tutti gli elementi della tavola periodica, e formano composti ionici o covalenti che sono spesso usati come materiali di partenza per la sintesi di altri composti sia inorganici che organici). A questo gruppo (il diciassettesimo) appartengono fluoro, cloro, bromo, iodio e astato, e la loro reattività si spiega con una proprietà chiamata elettronegatività. Questa, rappresentata da un valore numerico, esprime la forza con cui questi atomi attirano gli elettroni verso di sé, quando si trovano a socializzare con un metallo, il quale a sua volta non vede l’ora di cederglielo per legarsi.
Per completare il quadro, è necessario introdurre anche i concetti di energia di ionizzazione e affinità elettronica, che indicano rispettivamente l’energia necessaria per liberarsi di un elettrone, e la quantità di energia rilasciata in questa operazione. Scrutando la tavola periodica scopriamo che il fluoro è l’elemento più elettronegativo, mentre il cloro è quello con la più elevata affinità elettronica di tutti, pari a 349 kJ/mol o 3,6 elettronvolt.
Infatti il cloro è alla perenne ricerca di un elettrone facile, e dato che negli ambienti da lui frequentati pullulano gli atomi di sodio con i quali scambiarsi elettroni e garantirci infinite riserve di sale per cucinare e per tenere sgombre le strade dal ghiaccio durante l’inverno. “Un matrimonio perfetto” come dice scherzando Puru Jena, Ph.D e professore alla Virginia Commonwealth University!
Agli alogeni basta un elettrone per diventare felici, e sono molto più stabili quando sono negativi rispetto a quando si trovano in una condizione neutra.
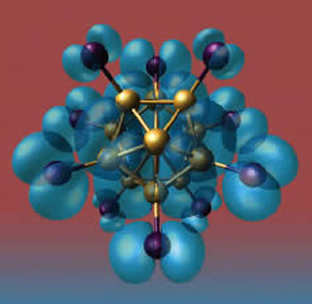
Tre atomi di alluminio simulano un atomo di iodio
Quando l'esafluoruro di platino, un gas di colore rosso, reagisce con un eccesso di xeno, il prodotto risultante è un solido giallo di formula bruta XePtF6 , noto come il primo composto stabile di un gas nobile.
Nel 1962, il chimico inglese Neil Bartlett ha scoperto che l’esafluoruro di platino reagisce con lo xeno per formare il primo composto di gas nobile conosciuto. Gli scienziati rimasero stupefatti perché lo xeno appartiene a un gruppo di elementi estremamente stabili, tanto da guadagnarsi l’appellativo di gas “nobili”, per la scarsissima propensione a legarsi con altri atomi, perfino tra di loro, tanto da essere gli unici gas che si trovano in natura a rimanere preferenzialmente monoatomici.
I superalogeni
Una dozzina di anni dopo, due scienziati sovietici, Gennady Gutsev e Alexander Boldyrev, hanno dimostrato che una classe più ampia di molecole con un atomo di metallo al centro circondato da atomi di alogeni, in analogia con l’esafluoruro di platino, possedeva un’affinità elettronica perfino superiore di quella del cloro. Queste molecole sono state chiamate “superalogeni”.
Ad esempio, potreste prendere un atomo di sodio e un atomo di cloro per costruire una molecola di cloruro di sodio e quindi attaccargli forzatamente un secondo atomo di cloro. Questo nuovo composto quindi diventerebbe nuovamente “affamato” di elettroni a causa del secondo atomo di cloro aggiunto. All’improvviso, l’affinità elettronica, che è la caratteristica che ci interessa, arriva a raggiungere un valore quasi doppio rispetto al cloro. Così diventa un superalogeno, un superatomo con proprietà degli alogeni potenziate, un supereroe della tabella periodica.
Jena, insieme a Anil Kandalam, Ph.D., professore assistente presso la McNeese State University, ha teorizzato che si potrebbe spingere l’affinità elettronica di un cluster o di una molecola verso livelli ancora maggiori, utilizzando i superalogeni come materia prima per la costruzione, al posto degli alogeni, per circondare l’atomo metallico. Il modello teorico è stato testato attraverso studi sperimentali condotti da Gerd F. Ganteför, Ph.D., presso la University of Konstanz. La nuova famiglia che entra a far parte di questa portentosa serie con affinità elettroniche estremamente elevate, è stata battezzata iperalogeni, una quarta dimensione nello spazio delle molecole complesse.
Il professor Jena rivela come sia stato impiegato un atomo di oro che è stato circondato da due superalogeni (boro-biossido), ottenendo un iperalogeno con una affinità elettronica ancora più grande.
L’approccio sinergico del team che coinvolge una fase teorica e una sperimentale, ha prodotto un iperalogeno di oro-borato con una affinità elettronica di 5,7 eV. I ricercatori sono ora al lavoro su un iperalogeno costruito con quattro superalogeni di boro-biossido e hanno già raggiunto un affinità elettronica di 7 eV, con l’obiettivo di costruire un iperalogeno da 10 eV. Questi nuovi aggregati molecolari chiamati iperalogeni potrebbero portare a ulteriori scoperte di nuovi composti chimici dalle proprietà imprevedibili.
Le indagini teoriche per il progetto sono state condotte da Jena e da Mary Willis presso la VCU, insieme a Kandalam. Il lavoro sperimentale è stato eseguito da Ganteför e Matthias Götz, dottorando presso la University of Konstanz.
La spintronica
Mentre l’elettronica governa la maggior parte degli oggetti con cui abbiamo a che fare, nei laboratori di ricerca si stanno compiendo passi significativi verso il suo superamento, ovvero la spintronica. Due recenti ricerche pubblicate su Nature Chemistry e su Science Express hanno permesso di testare la validità di due nuovi materiali come conduttori per i microprocessori del futuro. Il primo materiale è un aggregato di otto atomi di Cesio e uno di Vanadio ed è stato studiato da un team di ricercatori della Virginia Commonwealth University, del Naval Research Laboratory e dell’Istituto di ricerca Harish-Chandra di Allahabad (India). Il secondo è una lega di Telluro e Bismuto (Bi2Te3), già noto ai ricercatori, di cui sono state verificate le proprietà isolanti presso il National Accelerator Laboratori grazie al lavoro degli scienziati dell’Università di Stanford. Entrambi contribuiscono ad avvicinare il giorno in cui le informazioni non saranno più trasmesse dalla carica elettrica degli atomi, ma dalla rotazione degli elettroni.
Il superatomo magnetico
Il particolare super-atomo di Cesio-Vanadio è stata trovato mentre i fisici cercavano un aggregato di atomi che rimanesse stabile anche in gruppi multipli, che si combinasse cioè bene con se stesso. Il professor Shiv N. Khanna ha scoperto che con otto atomi di Cesio la stabilità era massima, non rimanevano cioè elettroni liberi di legarsi con altri elementi. La particolare configurazione atomica permette al Cesio-Vanadio di possedere una forte carica magnetica, pari a cinque magnetoni di Bohr, comportandosi quasi come un atomo di Manganese. «Il Cesio è un ottimo conduttore di elettricità – ha spiegato Khanna - e il super-atomo che ne deriva combina i vantaggi del magnetismo con la facilità di conduzione della sua superficie esterna». L’uso di una coppia di questo superatomo ha manifestato promettenti implicazioni per la spintronica. Sulla scia dello stesso studio i ricercatori ipotizzano che un superatomo composto da Oro e Manganese, che a differenza del Cesio-Vanadio non conduce l’elettricità, possa avere importanti applicazioni in campo biomedico per trasportare i principi attivi dei farmaci nel corpo.
Telluro e bismuto.

Superatomo bismuto telluro
La lega di Telluro e Bismuto si candida invece a soppiantare il Silicio ancor prima del superatomo Cesio-Vanadio. I test effettuati sulla sua conduttività hanno dimostrato che il materiale permette agli elettroni in superficie di viaggiare senza perdita di energia a temperatura ambiente. Un ottimo isolante che promette velocità stratosferiche se utilizzato nei microchip. Yulin Chen, a capo della ricerca, si è detto più che soddisfatto degli esperimenti, che hanno superato le previsioni teoriche: «La teoria ipotizzava prestazioni già sufficienti ma i test hanno dato risultati ancora migliori dimostrando che la trasmissione avviene anche a temperature più elevate del previsto, il che dovrebbe accelerare l’utilizzo del materiale – o di una sua derivazione – in campo industriale». Anche in questo caso le informazioni vengono trasmesse grazie alla rotazione degli elettroni. Ad avvicinare la lega di Telluro e Bismuto alla produzione contribuisce il fatto che il materiale è realizzabile con le attuali tecnologie per la produzione di microchip.

Eugenio Caruso - 01-03-2017