Nell’arco di qualche ora, tutto quello che la cellula aveva costruito
è in rovina: non resta altro che qualche bolla di membrana
In prima battuta, può essere difficile capire quando una cellula è sull’orlo
dell’autodistruzione. Sembra che stia facendo le sue solite cose, trascrivere geni
e fabbricare proteine. Gli organelli che funzionano come centrali elettriche
in miniatura, i mitocondri, stanno diligentemente producendo energia. Ma poi un mitocondrio
riceve un segnale ed ecco che le sue proteine, tipicamente placide, uniscono le
forze per formare un congegno mortale.Demoliscono la cellula con una scrupolosità da togliere il fiato.
Nell’arco di qualche ora, tutto quello che la cellula aveva costruito
è in rovina: non resta altro che qualche bolla di membrana.
«Sono davvero incredibili la velocità e l’organizzazione con cui
succede»,
commenta Aurora Nedelcu, biologa evoluzionista presso
l’Università del New Brunswick, in Canada, che ha studiato il
processo nelle alghe.
L’apoptosi, nome con cui il processo è conosciuto, sembra tanto
improbabile quanto è violenta. Eppure ci sono cellule che vanno
incontro a questa serie di tappe devastanti ma prevedibili per
suicidarsi di proposito. Quando i biologi la osservarono per la prima
volta furono scioccati dalla scoperta di una morte autoindotta
in organismi viventi, in lotta per sopravvivere. E nonostante
sia poi emerso che l’apoptosi è una forza creativa vitale per molte
creature pluricellulari, per la cellula che la esegue significa la
completa rovina. Come può essersi evoluto, e aver continuato a
sussistere, un comportamento che ha esito nella morte improvvisa
di una cellula?
I biologi molecolari hanno scoperto che gli strumenti per l’apoptosi
sono bizzarramente diffusi. E mentre cercavano di
identificarne le origini e i processi molecolari,
hanno scoperto qualcosa di ancora
più sorprendente: l’apoptosi può
essere fatta risalire ad antiche forme di
morte cellulare programmata messe
in atto da organismi unicellulari – persino
da batteri – che sembrano averle
evolute come comportamento sociale.
Uno studio pubblicato nell’autunno
2023 suggerisce che l’ultimo antenato comune tra lieviti ed esseri
umani – il primo eucariote, ossia una cellula con un nucleo e i
mitocondri – aveva già gli strumenti necessari per uccidersi circa
due miliardi di anni fa. E altre ricerche, tra cui un articolo fondamentale
pubblicato a maggio 2023 su «Cell» da Aaron Whiteley,
dell’Università del Colorado, indica che, quando questo organismo
era in vita, una forma di morte cellulare programmata esisteva
già da milioni di anni.
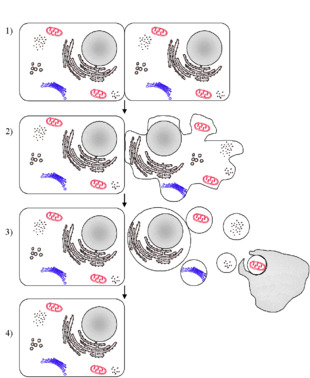
Apoptosis. Al contrario della necrosi, che è una forma di morte cellulare risultante da un acuto stress o trauma cellulare, l'apoptosi è portata avanti in modo ordinato e regolato, richiede consumo di energia e generalmente porta a un vantaggio durante il ciclo vitale dell'organismo (è infatti chiamata da alcuni morte altruista o morte pulita). Durante il suo sviluppo, ad esempio, l'embrione umano presenta gli abbozzi di mani e piedi “palmati”: affinché le dita si differenzino, è necessario che le cellule che costituiscono le membrane interdigitali si autodistruggano.
Alcuni ricercatori pensano che le origini dell’apoptosi praticata
nelle nostre cellule potrebbe essere fatta risalire al mitocondrio (vedi sotto),
che riveste un ruolo curiosamente centrale in questo
processo. Altri, invece, sospettano che le origini della morte cellulare
possano risiedere in un antico patto stipulato tra i nostri
antenati e i batteri. Qualunque sia stato il percorso, le nuove ricerche
fanno venire a galla prove che fanno pensare che la morte
cellulare programmata possa essere più antica di quanto avessimo
mai immaginato, e più universale. Perché la vita è così perseguitata
dalla morte?
Sul finire degli anni cinquanta del Novecento, il biologo cellulare
Richard Lockshin cominciò a interessarsi a ciò che succede
ai tessuti di cui un organismo non ha più bisogno. All’epoca
lavorava alla Harvard University nel laboratorio dell’esperto
di insetti Carroll Williams, che aveva ottenuto 20.000 bozzoli
di baco da seta dall’Asia; quando arrivarono in laboratorio, la loro
metamorfosi era già iniziata. In ogni bozzolo, le cellule del baco
da seta stavano morendo, così che la creatura potesse diventare
una farfalla. Lockshin procedette documentando la morte di
tessuti specifici dentro i loro corpi, fenomeno che chiamò «morte
cellulare programmata».
Circa nello stesso periodo, il patologo australiano John Kerr
stava puntando un microscopio elettronico sulle cellule di embrioni
di ratto, facendo una scoperta simile. Durante lo sviluppo
dell’embrione, nuove cellule si aggiungevano alla struttura
del corpo; allo stesso tempo, però, c’erano anche cellule che
morivano. Non era un incidente, né il risultato di un infortunio:
questa morte, che chiamò «apoptosi», era un «fenomeno attivo,
intrinsecamente controllato», scrisse Kerr. Negli embrioni di ratto,
la morte era parte integrante del piano di sviluppo.
I ricercatori che osservavano questo tipo di morte finirono
per arrivare a una spiegazione plausibile. Durante lo sviluppo, un
mucchio di cellule in rapida divisione diventa qualcosa con ali e
antenne, oppure con dita dei piedi e delle mani; lungo il percorso,
alcune di queste cellule devono togliersi di mezzo. La morte
cellulare programmata aveva poi un senso scientifico anche negli
adulti: le cellule non sane, come quelle con un DNA danneggiato,
devono essere capaci di autoeliminarsi da un corpo pluricellulare,
per non causare ulteriore distruzione alle cellule circostanti.
I ricercatori scoprirono inoltre che errori nel processo di apoptosi
possono portare a malattie, cosa anch’essa coerente. Nel cancro,
una cellula che sarebbe dovuta morire – una cellula il cui DNA è
così pieno di errori che avrebbe dovuto autodistruggersi – non lo
fa. Nelle malattie autoimmuni e in altre, cellule che non dovrebbero
morire muoiono e, viceversa, cellule che dovrebbero morire
non lo fanno.
Gli esperti pensavano, tuttavia, che questa capacità fosse un’esclusiva
degli organismi pluricellulari, che hanno corpi fatti di
molte cellule a vantaggio delle quali altre cellule possono morire.
Che benefici potrebbe mai trarre un organismo unicellulare dalla
propria stessa morte? Difficile che l’evoluzione favorisca un comportamento
che rimuove il suo portatore dal pool genetico. «Non
sembrava avere alcun senso che qualcosa si suicidasse attivamente
», è il commento di Pierre Durand, biologo evoluzionista all’Università
del Witwatersrand, in Sudafrica.
Man mano che gli scienziati definivano meglio i dettagli di
questi meccanismi di morte, però, alcuni iniziarono a capire che
anche gli organismi eucarioti unicellulari avevano strumenti e capacità
simili. Nel 1997, un gruppo di ricercatori con a capo il biochimico
Kai-Uwe Fröhlich riportò che le cellule di lievito si auto-disassemblavano metodicamente: il primo esempio noto di
«organismi eucarioti unicellulari» che avessero i meccanismi di
base della morte cellulare programmata. Presto le alghe unicellulari,
i protisti e altri funghi si unirono ai ranghi delle creature note
per praticare la morte autoindotta.
Mentre cercavano di capire come gli organismi avessero potuto
evolvere questa capacità, i biologi si trovarono costretti ad affrontare
un’altra questione: se la morte cellulare programmata
non era comparsa con la pluricellularità, allora da dove veniva?
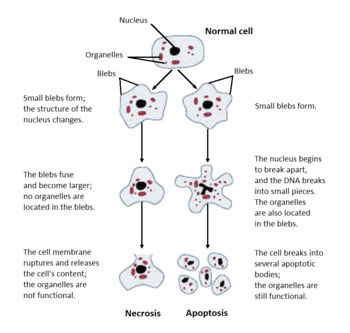
Illustrazione di necrosi e apoptosi
Ecco che cosa succede quando una cellula eucariotica si condanna
a morire.
In primo luogo, arriva un segnale che la fine è vicina. Se proviene
dall’esterno della cellula (se, cioè, le cellule circostanti
hanno decretato la morte della vicina), il segnale arriva sulla superficie
cellulare e si lega a un recettore letale, che dà l’avvio all’apoptosi.
Se il segnale proviene dall’interno (se cioè il motivo della
morte è, per esempio, un danno al genoma), il processo ha inizio
con l’attacco dei mitocondri contro la cellula in cui si trovano.
In ciascun caso, presto entrano in azione enzimi specializzati.
Alcuni fattori apoptotici, come le caspasi negli animali, possono
attivarsi l’un l’altro in una cascata di rapidità sorprendente che diventa
uno sciame e taglia a fette le strutture cellulari. Dopodiché,
il destino della cellula è segnato. «Molte strade portano alla morte
cellulare», spiega L. Aravind, biologo evoluzionista al National
Center for Biotechnology Information dei National Institutes of
Health statunitensi, e coautore dello studio su «Cell» del 2023.
Tutte finiscono con enzimi apoptotici e frammenti di proteine e
DNA là dove un tempo c’era la cellula.
L’apoptosi è controllata in modo così stretto, e praticata così
ampiamente, che è difficile non chiedersi dove abbiano avuto
origine i suoi meccanismi, intendendo con questo sia i pezzi
che ne costituiscono il macchinario, che devono essere stati i
primi a formarsi, sia il modo in cui lavorano insieme. Questa curiosità
è ciò che ha portato Szymon Kaczanowski e Urszula Zielenkiewicz,
dell’Accademia delle scienze polacca, a una recente
serie di esperimenti. I due volevano capire se le proteine apoptotiche
di un organismo eucariote continuano a funzionare una
volta inserite nella macchina apoptotica di un suo lontano parente.
Se il processo continua a funzionare, pensavano i ricercatori,
le funzioni degli enzimi (il modo in cui fanno a pezzettini il DNA
o attivano altre parti del processo) devono essersi conservate, in
buona parte, per lunghi periodi di tempo.
Il gruppo di ricerca ha fabbricato lieviti chimerici contenenti
enzimi apoptotici da tutto l’universo eucariotico: piante di
senape, funghi mucillaginosi, esseri umani e il parassita che provoca
la leishmaniosi. I ricercatori hanno poi indotto l’apoptosi. E
hanno osservato che molte di queste chimere erano in grado di
suicidarsi, a prescindere dall’origine delle proteine. In aggiunta,
commenta Kaczanowski, «i diversi segni distintivi dell’apoptosi
spesso mantenuti», compresa la rottura del DNA e la condensazione
della cromatina nel nucleo.
I ricercatori si sono anche chiesti se le proteine batteriche potessero
sostituirsi a quelle eucariotiche. Quando hanno inserito
geni per proteine analoghe da una manciata di batteri, hanno osservato
la morte programmata in alcune chimere, sebbene non in
tutte. Questo, secondo i ricercatori, suggerisce che gli strumenti
per la morte autoindotta precedano addirittura gli eucarioti.
Non tutti sono d’accordo con questa interpretazione: alcune di
queste proteine, in particolare quelle che tagliano il DNA e le proteine,
secondo Aravind sono pericolose per la cellula, che potrebbe
morire soltanto a causa dei danni inferti anziché per un processo
apoptotico.
Nonostante ciò, Kaczanowski e Zielenkiewicz credono di aver
osservato una vera e propria morte cellulare programmata. E una
delle loro congetture sul perché i geni batterici possono funzionare
negli eucarioti si collega a un’idea che circola tra i biologi da
decenni.
Questa teoria chiama in causa il mitocondrio, un organello
che un tempo era un batterio autonomo. Si tratta del produttore
di energia della cellula, che entra in gioco più e più volte nei percorsi
dell’apoptosi. Guido Kroemer, che studia il ruolo dei mitocondri
nell’apoptosi, li ha soprannominati «gli organelli suicidi».
«Molti lo chiamano il boia della morte cellulare», dice Nedelcu.
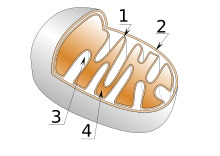
Schema di un mitocondrio
1 Membrana interna
2 Membrana esterna
3 Cresta
4 Matrice
Visto al microscopio, il mitocondrio è proprio grazioso: una
sacca ovale ordinata che contiene un labirinto di membrane.
Scompone gli zuccheri per generare l’ATP, una molecola la cui
energia alimenta quasi tutti i processi cellulari. Non sappiamo di
preciso come è finito dentro di noi. Il batterio originale potrebbe
essere stato preda del nostro antenato unicellulare ed essere sfuggito
alla sua digestione in modi ancora misteriosi. O potrebbe essere
stato una cellula adiacente che ha condiviso le risorse con il
nostro antenato fino al punto in cui i loro destini si sono così intrecciati
che i loro corpi sono diventati uno solo.
Quali che siano state le sue origini, il mitocondrio ha un suo
proprio, piccolo genoma, residuo dell’epoca in cui era indipendente.
Molti dei suoi geni, tuttavia, si sono spostati nel genoma
dell’organismo ospite. Nel 2002, Aravind ed Eugene Koonin hanno
scritto un articolo fondamentale in cui prendevano in considerazione
l’idea che gli eucarioti potrebbero aver acquisito alcuni
dei loro geni per l’apoptosi dai mitocondri. Questo minuscolo residuo
di batterio potrebbe essere la fonte di alcuni degli strumenti
che le cellule eucariotiche usano per suicidarsi.
I geni per l’apoptosi ricordavano a Kaczanowski e a Zielenkiewicz
una corsa agli armamenti tra un predatore e la preda.
Nel loro nuovo articolo hanno ipotizzato che potrebbero essere
residui degli strumenti che furono evoluti nella notte dei tempi da
un organismo preda – presumibilmente il batterio mitocondriale
originario – per difendersi.
Forse, una volta catturate all’interno del nostro antico antenato,
le proteine apoptotiche diventarono un modo, per il mitocondrio,
di spingere l’ospite a cambiare comportamento: questa è
un’ipotesi raccolta da Durand e da Grant Ramsey, un filosofo della
scienza dell’Università Cattolica di Lovanio, in Belgio, in un articolo
di rassegna pubblicato su «History and Philosophy of the Life
Sciences» a giugno 2023. O forse sono il residuo di un modo con
cui il mitocondrio si assicurava che l’ospite non potesse sbarazzarsi
di lui: un veleno di cui solo il mitocondrio possedeva l’antidoto. In qualche punto del percorso, il processo è stato inglobato
o trasformato dall’ospite e una sua variante si è evoluta nell’apoptosi
vera e propria.
La ricerca di risposte sulle origini dell’apoptosi eucariotica sembra
portare gli scienziati sempre più in profondità nel mondo dei
batteri. Alcuni, infatti, si chiedono se queste risposte non possano
risiedere nel motivo per cui gli organismi unicellulari si tolgono la
vita. Se una qualche forma di morte cellulare programmata è più
antica della vita pluricellulare, più antica persino degli eucarioti,
forse comprendere perché ha luogo in organismi che non hanno
corpi che ne traggano un vantaggio né mitocondri per accelerare
il processo può spiegare come tutto ha avuto inizio.
Un motivo per cui un organismo unicellulare potrebbe scegliere
di morire è aiutare i suoi vicini.
Negli anni Duemila, quando Durand era un ricercatore
post-dottorato presso l’Università dell’Arizona, durante un
esperimento con un’alga eucariotica unicellulare scoprì qualcosa
di molto interessante. Quando nutriva le alghe con i resti di loro
simili che erano morte per morte cellulare programmata, le
cellule vive prosperavano; quando, invece, le nutriva con i resti
delle loro consimili morte in modo violento, la crescita delle alghe
rallentava.
A quanto pareva, la morte cellulare programmata generava, a
partire da frammenti morti, risorse utilizzabili. Il ricercatore scoprì però che questo processo portava vantaggi soltanto a parenti
dell’alga morta. «Per organismi di specie diverse, in realtà era
dannoso», ha detto. Nel 2022 un altro gruppo di ricerca ha confermato
il risultato in un’alga diversa.
Questa scoperta forse spiega come possa evolversi la morte
cellulare in creature unicellulari. Se un organismo è circondato
dai suoi simili, la sua morte può portare loro nutrienti e, di conseguenza,
promuovere la sopravvivenza di organismi con cui è imparentato.
Ciò crea un’opportunità perché la selezione naturale
selezioni gli strumenti coinvolti nella morte autoindotta.
Anche i batteri sono unicellulari e molti vivono tra i propri simili.
Che siano anche loro capaci di morire per il bene comune? Ci
sono indizi che, nelle condizioni giuste, batteri infettati da un virus
potrebbero suicidarsi per bloccare la diffusione della malattia.
Queste rivelazioni hanno riplasmato il modo in cui i ricercatori
considerano la morte cellulare programmata. E di recente, Aravind
ha scoperto un altro tassello del puzzle.
Questo tassello coinvolge regioni proteiche chiamate domini
NACHT, presenti in alcune proteine apoptotiche animali. I domini
NACHT esistono anche nei batteri; in natura, osserva Aravind,
i microbi che hanno il maggior numero di domini NACHT condividono
quella che ha tutti gli aspetti di una vita pluricellulare. Vivono
in colonie, cosa che li rende particolarmente vulnerabili al
contagio e suscettibili di beneficiare di un mutuo sacrificio.
Un collega di Aravind, Aaron Whiteley, nel suo laboratorio
all’Università del Colorado ha dotato Escherichia coli di domini
NACHT, ha fatto crescere questi batteri in provetta e li ha infettati
con virus. I ricercatori hanno osservato con stupore che le proteine
con i domini NACHT innescavano una forma di morte cellulare
programmata e che le cellule infettate si suicidavano così rapidamente
che i virus non riuscivano a replicarsi. Il loro sacrificio,
ha detto Aravind, proteggeva dall’infezione le cellule circostanti.
Secondo Aravind, la conservazione di questi domini racconta
una storia delle origini dell’apoptosi. «Avevamo già un apparato
precostituito per la morte cellulare che era lì, in certi batteri», osserva.
E poi, a un certo punto, alcune linee evolutive di cellule eucariotiche
si sono impossessate di questa cassetta per gli attrezzi,
che ha finito per dotare le cellule degli organismi pluricellulari di
un meccanismo per morire a vantaggio del bene comune.
Il ricercatore non crede più che le prove puntino al mitocondrio
come unica fonte batterica delle proteine apoptotiche. Il mitocondrio
è il principale residuo batterico ancora in vita nella
maggior pare delle cellule eucariotiche, e 25 anni fa, a suo parere,
era il candidato più logico per questi geni misteriosi. Da allora,
però, è emersa un’altra consapevolezza: probabilmente il mitocondrio
non era solo.
A poco a poco i ricercatori hanno compreso che i genomi eucariotici
contengono molte tracce di geni batterici, residui di
una sfilata silenziosa di altre creature che hanno lasciato i propri
segni su di noi. Potrebbero essere stati dei simbionti, come il mitocondrio,
che sono comparsi e scomparsi da varie linee evolutive
eucariotiche lasciandosi dietro dei geni. «Ormai dovremmo renderci
conto che probabilmente questa situazione è continuata durante
tutta l’evoluzione degli eucarioti», commenta Aravind.
I geni coinvolti nell’apoptosi potrebbero essere arrivati da precedenti
partner simbiotici che, da allora, sono scomparsi. O potrebbero
essere il risultato di un trasferimento di geni orizzontale
– un processo un tempo ritenuto raro, ma che oggi si considera
relativamente diffuso – in cui i geni possono saltare da un organismo
all’altro attraverso processi che stiamo ancora cercando di
comprendere. Pacchetti di geni utili possono spostarsi tra i vari
regni della vita e persistere in nuovi organismi, se danno vantaggi
abbastanza grandi.
Uno di questi vantaggi, per quanto strano possa sembrare, potrebbe
proprio essere l’autodistruzione programmata.
Tutto ciò è importante perché mette l’accento sull’intricata realtà
che si nasconde dietro l’espressione superficiale «sopravvivenza
del più adatto». L’evoluzione opera in modi sorprendenti,
e i geni hanno molti scopi. Eppure, sta diventando sempre più
chiaro che qualche tipo di collettività primitiva – e, con essa, auto-
sacrifici organizzati di creature viventi – è vissuta, probabilmente
per miliardi di anni, prima della nascita della vita pluricellulare.
Forse, mentre gli scienziati continuano a ricostruire
le origini della morte cellulare, capiremo meglio che cosa sia la
morte e, con essa, la vita.
L’originale di questo articolo è stato pubblicato il 6 marzo 2024
da QuantaMagazine.org, una pubblicazione editoriale indipendente
on line promossa dalla Fondazione Simons per migliorare la comprensione
pubblica della scienza. Traduzione ed editing a cura di «Le Scienze».
Riproduzione autorizzata, tutti i diritti riservati.
MITOCONDRIO
Il mitocondrio è un organulo cellulare multiplo dotato di DNA proprio presente nella maggior parte degli organismi eucarioti, sia animali sia vegetali.
Tre specie di Loricifera e l'Henneguya zschokkei, organismi eucarioti pluricellulari anaerobi, non posseggono mitocondri. Alcune ricerche hanno dimostrato che alcuni organismi eucarioti, come ad esempio i parassiti Giardia lamblia, Entamoeba histolytica e Trachipleistophora hominis, che apparentemente non possiedono mitocondri, hanno subito una loro involuzione, con la trasformazione in organelli vestigiali mancanti della loro funzione biochimica originaria.
I mitocondri sono sede della respirazione cellulare aerobica, da cui si genera adenosina trifosfato (ATP) che viene utilizzata in tutta la cellula come fonte di energia chimica. Eseguono inoltre la sintesi degli acidi grassi (mtFASII), essenziale per la biogenesi mitocondriale e la respirazione cellulare. Furono scoperti da Albert von Kölliker nel 1857 nei muscoli volontari degli insetti. Il termine mitocondrio fu coniato da Carl Benda nel 1898. Sono stati definiti "la centrale elettrica della cellula" dal biologo Philip Siekevitz nel 1957[6
Eugenio Caruso - 12 gennaio 2025

Tratto da le scienze